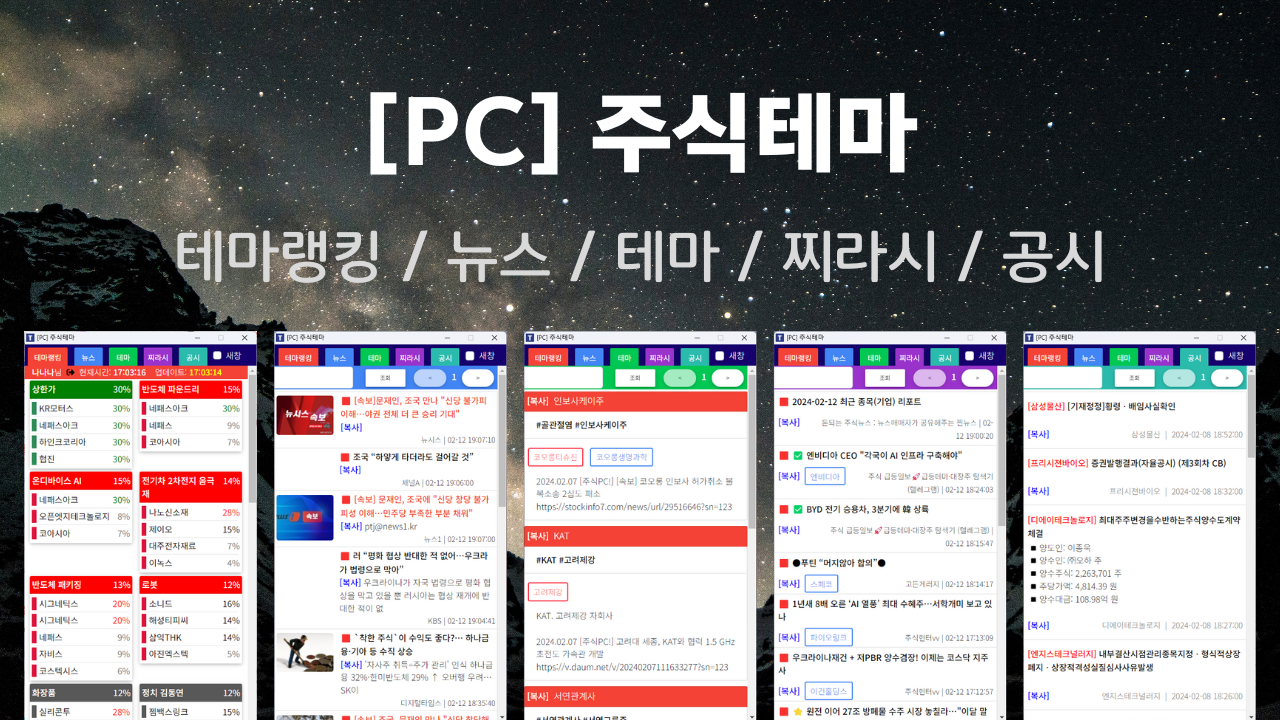
[주식뉴스 PRO] PC 프로그램
주식뉴스!

◾가장 빠르고 막강한 뉴스 프로그램, HTS에 없는 뉴스, 실시간 뉴스
◾뉴스픽R - 가장 빠른 실시간 뉴스(뉴스/속보/공시/특징주/임상)
◾HTS와 연동된 다양한 기능(상승 종목 뉴스, VI 들어간 종목 뉴스, 예상 상승 랭킹 뉴스)
◾찌라시R - 수 많은 여러 찌라시를 모아서 빠르게 제공
◾뉴스픽R - 가장 빠른 실시간 뉴스(뉴스/속보/공시/특징주/임상)
◾HTS와 연동된 다양한 기능(상승 종목 뉴스, VI 들어간 종목 뉴스, 예상 상승 랭킹 뉴스)
◾찌라시R - 수 많은 여러 찌라시를 모아서 빠르게 제공
|
◾배당구분: 에스티팜(주) ◾배당종류: ◾1주당배당금: 차등배당 여부: ◾시가배당율: % ◾배당금총액: 0 원 ◾배당기준일: |
|
◾배당구분: 에스티팜(주) ◾주주명부폐쇄(기준일): ▫️ 시작일: ▫️ 종료일: ▫️ 기준일: ◾목적: |
PC 프로그램(유료)
PC 프로그램(무료)
안드로이드 앱